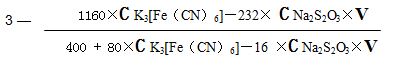藍色氧化鎢氧指數測定方法

1.1 基本原理
藍鎢中氧指數的測定,是基于它能溶解于氫氧化鉀和一定量的鐵氰化鉀溶液,生成的鎢酸鉀(K2WO4),過量的鐵氰化鉀在酸性溶液中與碘化鉀作用,幷釋放出碘,然後用硫代硫酸鈉標準溶液滴定,從而計算出藍鎢中的氧指數。 其主要反應方程式如下:
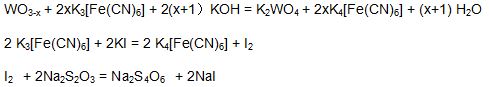
1.2 試劑
⑴氫氧化鉀,分析純,10g/100ml;
⑵鹽酸,分析純,1+1;
⑶碘化鉀,分析純,10g/100ml;
⑷硫酸鋅,分析純,10g/100ml;
⑸澱粉,分析純,1g/100ml;
⑹重鉻酸鉀標準溶液:準確稱取2.4515g經140~150℃烘乾2h的基準重鉻酸鉀溶解于水,移入1000ml容量瓶中,用水稀釋至刻度,混勻。此標準溶液的濃度爲0.05mol/L。
⑺硫代硫酸鈉標準溶液:稱取12.5g硫代硫酸鈉溶解于經煮沸幷冷却至室溫的水中,加0.1g碳酸鈉,充分混勻,過濾于1000ml棕色容量瓶中,用水稀釋至刻度,混勻,放置一星期後進行標定。此溶液每毫升約爲0.05mol/L。
標定:準確量取20.00ml、0.05mol/L的重鉻酸鉀標準溶液于250 ml的三角瓶中,加入20 ml(1+1)鹽酸,20 ml碘化鉀溶液,混勻,放置5min後,用硫代硫酸鈉標準溶液滴定至溶液呈淡棕色,再加入1 ml澱粉溶液,繼續滴定至溶液藍色消失爲終點,所消耗硫代硫酸鈉標準溶液的體積爲V0ml,其化學反應如下:
3 Na2S2O3 + K2Cr2O7 + 6HCl = 2 Cr(OH)SO4 + 4 NaCl + 3S + 2H2O + KCl + Na2SO4
按下式計算硫代硫酸鈉標液的摩爾濃度:
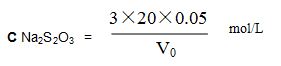
⑻鐵氰化鉀標準溶液:稱取66.0克分析純鐵氰化鉀于250 ml燒杯中,加水溶解後,移入1000ml容量瓶中,用水稀釋至刻度,混勻,此溶液每毫升約爲0.02mol/L。
標定:準確量取5.00ml鐵氰化鉀標準溶液于250 ml三角瓶中,加入20 ml(1+1)鹽酸、20 ml碘化鉀溶液,混勻,放置5min後,加入 20 ml硫酸鋅溶液,用0.05mol/L的硫代硫酸鈉標液滴定至淡棕色,再加入1 ml澱粉溶液,繼續滴定至溶液藍色消失爲終點。所消耗硫代硫酸鈉標準溶液的體積爲V1ml,計算鐵氰化鉀標準溶液的摩爾濃度:
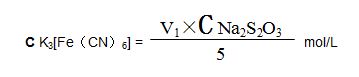
2.1 分析方法
準確稱取0.2000克試樣于250 ml三角瓶中,加入5.00ml鐵氰化鉀標準溶液,15ml氫氧化鉀溶液,用少量水吹洗瓶壁,在低溫處(約70℃)加熱溶解15min,待試樣完全溶解後取下,用水冷却至室溫。加入20 ml(1+1)鹽酸,20 ml碘化鉀溶液,混勻後,放置5min後,用0.05mol/L的硫代硫酸鈉標液,滴定至淡棕色,再加入1 ml澱粉溶液,繼續滴定至溶液藍色消失爲終點。計下所消耗硫代硫酸鈉標準溶液的體積爲Vml。
2.2 氧指數計算方法
綜上所有反應式及測定數據,所計算得藍鎢氧指數: